Explication du phénomène
Planètes, eau, air, êtres vivants… Tout ce qui nous entoure constitue ce que l’on appelle la matière. Celle-ci est composée d’éléments extrêmement petits : les atomes. Certains atomes ne changent pas : on dit qu’ils sont stables. D’autres sont instables. Ils renferment un surplus d’énergie qui les pousse à se transformer par désintégration et à devenir d’autres atomes. En se transformant, ils expulsent leur énergie excédentaire sous la forme de rayonnements invisibles à l'œil nu. C’est ce que l’on appelle la radioactivité.
Atomes et éléments chimiques
Au cœur de la matière, les atomes sont formés des mêmes minuscules particules qui déterminent leurs propriétés. Le nombre de ces particules diffère d’un atome à l’autre. Les atomes peuvent être stables, d'autres sont radioactifs : leur noyau, instable, dégage un trop-plein d’énergie sous la forme de rayonnements.
Qu’est-ce qu’un atome ?
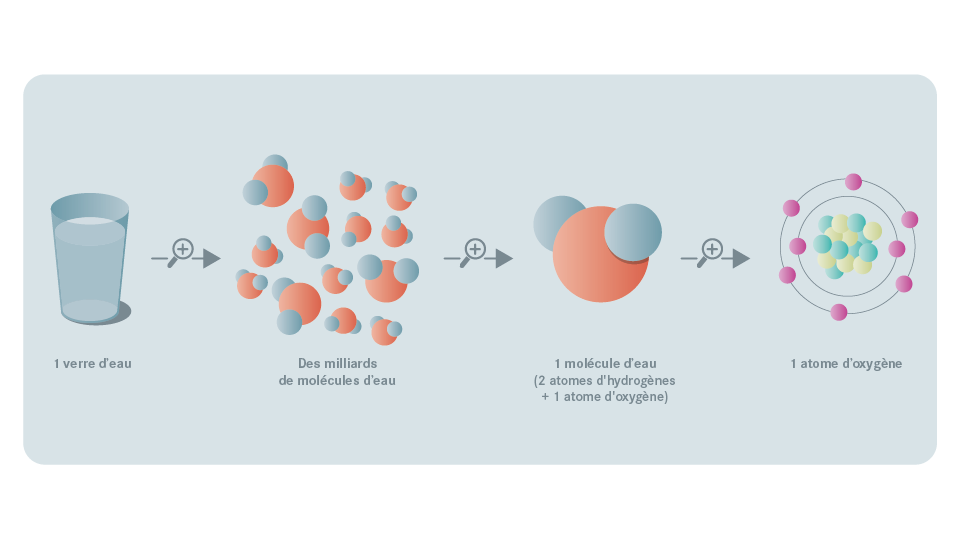
Tous les objets du quotidien, de même que l’eau, l’air que nous respirons ou notre propre corps, constituent ce qu’on appelle la matière. En observant la matière de très près, on trouve des molécules plus ou moins complexes. Chacune de ces molécules est composée de plusieurs atomes dont la taille est inférieure à un dix millionième de millimètre (1/10 000 000e de mm).
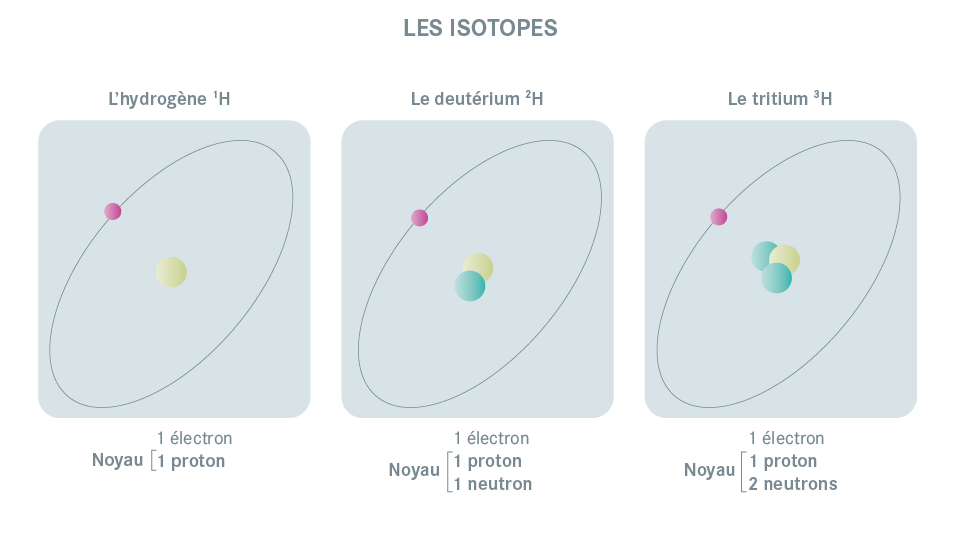
Exemple : La molécule de l’eau, que l’on note "H2O", compte deux atomes d’hydrogène (H) et un atome d’oxygène (O). Chaque atome comprend un noyau autour duquel des électrons gravitent à très grande vitesse. Ce noyau est constitué de deux types de particules : les protons et les neutrons.
Des éléments chimiques par dizaines
C'est le nombre de protons qui détermine les propriétés chimiques des atomes. Ainsi, les atomes ayant le même nombre de protons appartiennent à un même groupe appelé élément chimique. Il existe de nombreux éléments chimiques comme le chlore, le carbone, l’hydrogène, le calcium...
Exemple : Un atome qui possède 53 protons est un atome d’iode, tandis qu’un atome qui en compte six est un atome de carbone.
Le saviez-vous ?
En 1869, Dimitri Ivanovitch Mendeleïev (1834-1907), un chimiste russe, publie la première version de sa classification périodique des éléments. Encore utilisé de nos jours, ce tableau est complété lorsque de nouveaux éléments chimiques sont découverts
Comment naît la radioactivité ?
Deux atomes peuvent avoir un même nombre de protons, mais un nombre différent de neutrons. Ce sont alors des isotopes. Certains isotopes ont un noyau instable : ils sont alors radioactifs.
Les isotopes relèvent donc du même élément chimique mais ont des propriétés radiologiques différentes.
Exemples : L’iode 127, qui est stable, possède par exemple 53 protons et 74 neutrons alors que l’iode 129, radioactif, possède 53 protons et 76 neutrons.
Ainsi, on distingue des isotopes stables, qui restent identiques à eux-mêmes indéfiniment, et des isotopes instables, aux propriétés radioactives. Cette instabilité peut être dû à :
- un trop grand nombre de particules,
- un écart trop important entre le nombre de protons et de neutrons,
- un trop plein d'énergie.
De ce fait, le noyau d'un atome instable corrige naturellement ces anomalies en se désintégrant et en émettant des rayonnements afin de devenir stable.
D’où vient le nom des éléments chimiques ?
L’appellation des éléments chimiques peut être inspirée par la mythologie (tantale, mercure) ou par la géographie (polonium, francium, europium). L’élément peut aussi porter le nom d’une couleur, à l’exemple du rubidium (du latin rubidius, "rouge foncé"). Parfois, un élément reçoit le nom d’un scientifique illustre : le curium et le fermium ont été baptisés ainsi en hommage au couple Curie et au physicien italien Enrico Fermi. Les éléments chimiques nouvellement découverts sont nommés par l’Union internationale de chimie pure et appliquée (UICPA). Le dernier élément découvert a été identifié en juin 2009. Il s’agit du copernicium, ainsi baptisé en l’honneur de l’astronome polonais Nicolas Copernic.
Les différents rayonnements
Dotés d’un surplus d’énergie, les atomes radioactifs se désintègrent naturellement en émettant des rayonnements invisibles qui diffèrent par leur nature et leur pouvoir de pénétration dans l'air ou la matière. Il existe principalement trois types de rayonnements : alpha, bêta ou gamma.
Les atomes radioactifs : une énergie débordante !
La radioactivité est un phénomène naturel qui naît au cœur de l’atome. Dans le noyau instable d’un atome radioactif, il existe ainsi un surplus d’énergie qui conduit à une désintégration de l’atome en un autre atome. Pendant cette transformation, l’atome expulse son énergie excédentaire sous la forme de rayonnements invisibles : on parle de rayonnements ionisants.
Il existe trois types de rayonnements ionisants de nature et d’intensités différentes : alpha, béta et gamma.
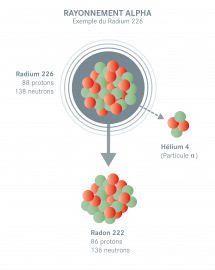
Le rayonnement alpha
Le rayonnement alpha est émis par les atomes possédant trop de protons ou de neutrons. Il correspond à l’émission d’un noyau d’atome d’hélium, composé de deux protons et de deux neutrons : la particule alpha. Sa portée dans l’air est de quelques centimètres seulement. Il peut être arrêté par une simple feuille de papier.
Exemple : Un atome de radium 226 se transforme en un atome de radon 222. Sa désintégration provoque l’émission d’une particule alpha.
Le rayonnement bêta
Le rayonnement bêta est émis par des atomes ayant un écart trop important entre le nombre de protons et de neutrons. Il correspond à deux types de transformations pouvant survenir dans un radionucléide :
- un neutron se transforme en proton et le noyau émet un électron chargé négativement,
- un proton se transforme en neutron et le noyau émet un anti-électron chargé positivement.
Sa portée dans l'air est de quelques mètres. Il peut être arrêté par une feuille d'aluminium.
Exemple : Un atome de cobalt 60 devient un atome de nickel 60. Un de ses neutrons se transforme en proton en émettant un électron.
Le rayonnement gamma
Le rayonnement gamma est émis par les atomes possédant un trop plein d'énergie. Il s’agit d’une onde électromagnétique de même nature que la lumière ou les rayons X, mais beaucoup plus énergétique.
Le rayonnement gamma est bien plus pénétrant que les autres types de rayonnements. En fonction de son énergie, il peut parcourir plusieurs centaines de mètres dans l’air. Une forte épaisseur de plomb ou de béton est nécessaire pour les arrêter.
Exemple : Le cobalt 60 se transforme en nickel 60 "excité", qui lui-même retrouve sa stabilité en émettant des rayonnements gamma.
La décroissance radioactive
Phénomène naturel, la radioactivité s’atténue progressivement au fil du temps avec la désintégration des atomes radioactifs : c'est la décroissance radioactive. Plus ou moins lent selon les radionucléides, ce processus détermine la durée de vie des atomes radioactifs et leur niveau de radioactivité.
Les atomes radioactifs ont une vie limitée
Instables, les atomes radioactifs se désintègrent et donnent naissance à d'autres atomes. Cependant, chaque radionucléide reste radioactif pendant une durée qui lui est propre. Celle-ci est définie par ce que l’on appelle la période radioactive.
Qu’est-ce qu’une "période radioactive" ?
C’est le laps de temps au bout duquel la moitié de la quantité d'un même radionucléide aura naturellement disparu par désintégration. Le niveau de radioactivité d'un échantillon d'un même atome est donc divisé par deux.
Exemple : La période radioactive du tritium est de 12,3 ans. Sur un échantillon de 3 grammes de tritium, il n'en restera que 1,5 grammes au bout de cette période. Cet échantillon sera donc deux fois moins radioactif !
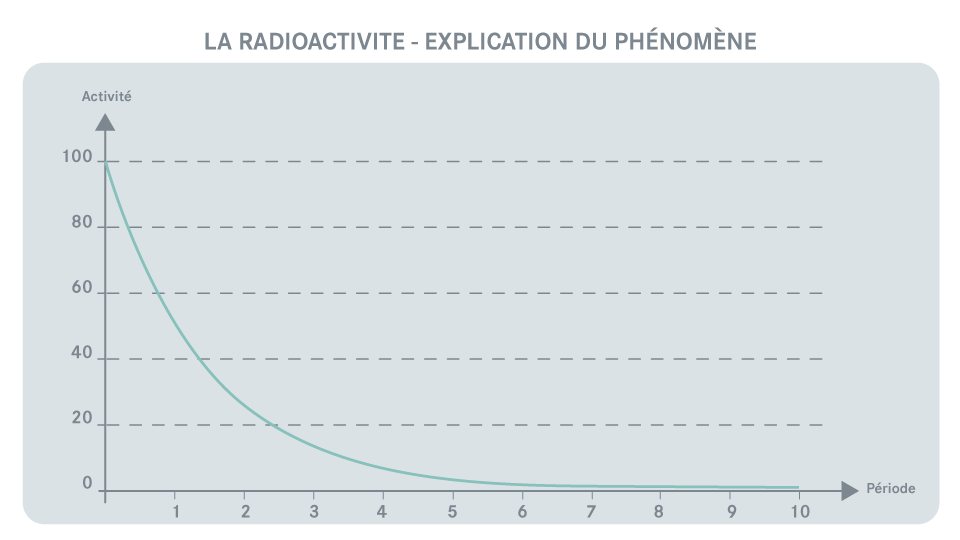
« Au bout de 10 périodes
radioactives, seul 1 atome
radioactif sur 1 000 subsiste. »
Le saviez-vous ?
Il faudrait aligner 100 millions d'atomes pour atteindre une longueur d'1 cm !
La période radioactive est également appelée "demi-vie". Elle peut varier considérablement d’un radionucléide à un autre. Ainsi, la période radioactive du polonium dure une fraction de seconde, tandis que celle de l’uranium 238 s’étale sur 4,5 milliards d’années.
Des atomes plus ou moins radioactifs
À l’état naturel, certains radionucléides sont faiblement radioactifs, alors que d’autres sont très radioactifs. Pour deux échantillons de matière contenant chacun des radionucléides de deux types différents, on peut ainsi passer d’une radioactivité de quelques dizaines de becquerels à plusieurs millions de milliards de becquerels par gramme.
| Radioélément | Période | Activité massique |
|---|---|---|
| Iode 131 | 8 jours | 4,6 millions de milliards de Bq/g |
| Césium 137 | 30 ans | 3 200 milliards de Bq/g |
| Plutonium 239 | 24 000 ans | 2,3 milliards de Bq/g |
| Uranium 238 | 4,5 milliards d'année | 12 300 Bq/g |
Il existe un lien direct entre la durée de vie d’un atome radioactif et l’intensité de sa radioactivité (appelée activité). En effet, pour deux échantillons de matière du même poids, celui contenant les radionucléides ayant la période radioactive la plus longue sera le moins radioactif.
Le parcours des atomes radioactifs
Tout atome radioactif subit une ou toute une série de désintégrations qui s’enchaînent jusqu’à ce qu’il donne naissance à un atome stable. En se désintégrant, certains radionucléides peuvent donner naissance à d’autres radionucléides, qui à leur tour vont se désintégrer en atomes radioactifs ou en atome stable.
Du radionucléide à l’atome stable : la chaîne de filiation
Les atomes radioactifs sont instables : ils se transforment par désintégration pour devenir d’autres atomes radioactifs ou des atomes stables. Ce phénomène naturel se déroule dans un ordre et dans un laps de temps spécifiques à chaque radionucléide. Cet enchaînement est appelé "chaîne de désintégration" ou "chaîne de filiation".
Dans chaque chaîne de filiation, le radionucléide de départ est nommé "radionucléide père". Chaque radionucléide intermédiaire, produit par désintégration, est appelé "radionucléide fils". Au bout de la chaîne de filiation, le radionucléide perd sa radioactivité et devient définitivement un atome stable.
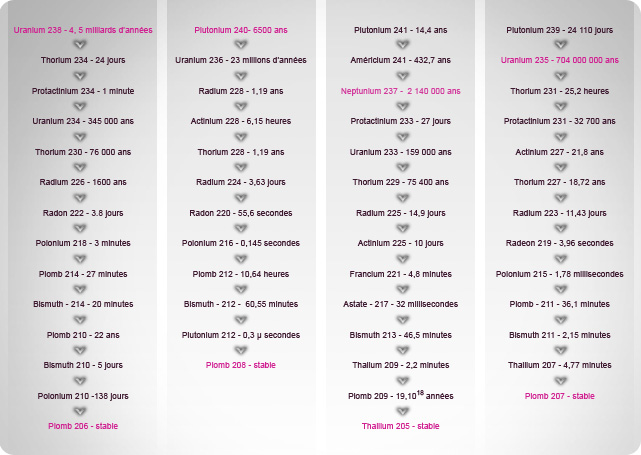
Quelques chaînes de filiation...
Il existe quatre principales chaînes de filiation :
Le saviez-vous
L’uranium 238 a une période radioactive de 4,5 milliards d’années, soit l’âge de la Terre ! Ainsi, la moitié de l’uranium 238 présent lors la création de notre planète a aujourd’hui disparu par désintégration naturelle. En se désintégrant, il a donné naissance à de nombreux autres atomes radioactifs comme le radium 226, le radon 222 ou le polonium 210.